来源于:BioWorld
从太上老君的炼丹炉,到谷歌建立的抗衰老公司Calico,人类对长生不老仙丹的探求始终没有停步。
人类衰老和器官衰竭在分子水平上伴随着体细胞内的端粒的变短(端粒,telomere: 染色体末端的重复DNA序列)。过短的端粒会破坏基因组的稳定性,引发(干)细胞的沉睡(senescence),导致组织和器官的功能退化。因此,有效的延长端粒的药物对治疗先天性早衰、肝肺硬化(fibrosis)、神经和骨髓衰竭等短端粒疾病有重要的临床价值。
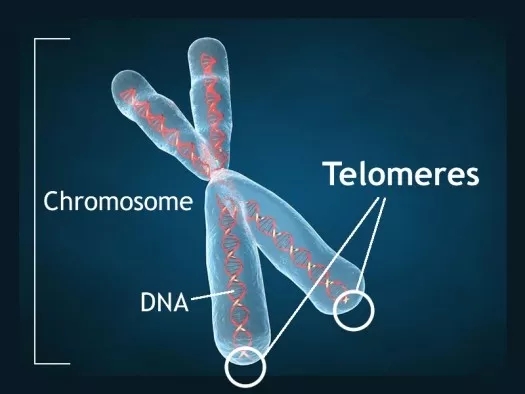
甚至还有临床试验在试图通过延长端粒的方法去逆转人类的衰老进程。详情:世界首个返老还童的收费临床试验获批,“只需”100万美元,让你年轻20岁
端粒酶(telomerase)是人体,乃至单细胞酵母中,可以直接延长端粒的唯一分子机器。这个蛋白RNA复合体以非编码RNA亚基hTR为模板,由逆转录酶TERT去催化端粒的延长。端粒酶的活性对TERT和hTR的分子丰度非常的敏感:单拷贝TERT或hTR的失活突变会造成50%的端粒酶的下降,但也足以引发先天性的短端粒早衰病;表达外源的TERT和/或hTR在体外细胞系里足以引发端粒的延长,也证明了提高hTR的分子水平对延长端粒的可行性。hTR的调控主要发生于转录后的一系列的RNA biogenesis步骤,包括hTR转录后的修饰(PTM)和成熟,细胞内的定位,以及和TERT的有效组装,直至形成能够延长端粒的全酶(见下图)。
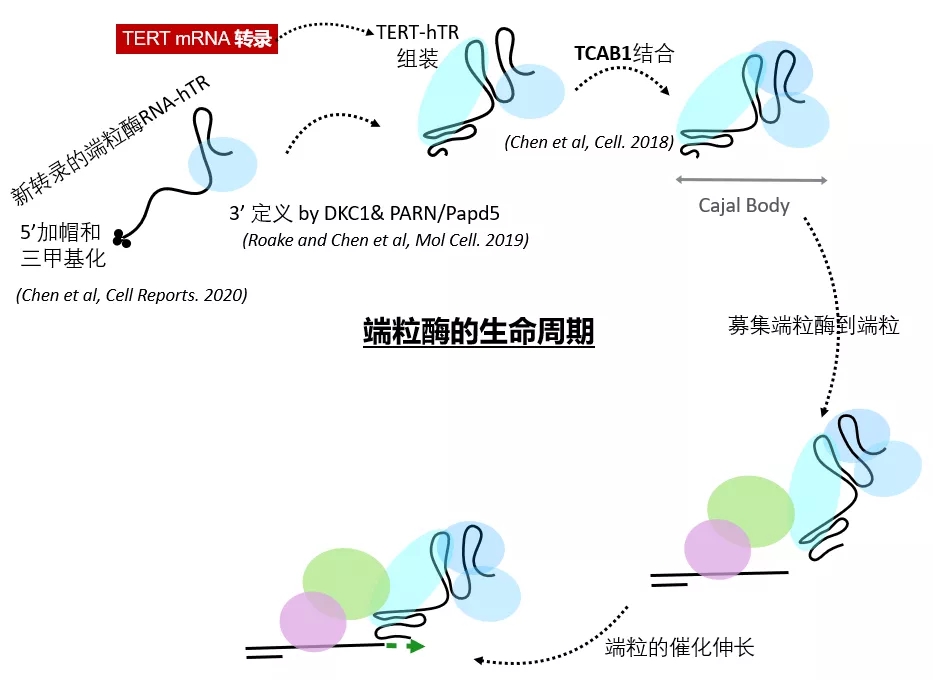
以短端粒为特质的早衰病变阐述了维持端粒长度的必须分子机理,但激活端粒酶而造成端粒延长的突变和实验报道并无先例。因此,系统性的研究端粒酶RNA亚基hTR的biogenesis 中的具体步骤可以弥补这个知识的空缺,从而为提高细胞内hTR丰度,和端粒伸长提供新的药物靶点。
端粒酶hTR和其它的RNA聚合酶II的产物一样,其5’端的非典型的鸟苷上在共转录过程中会获得单甲基化的修饰 (m7G)。信使mRNA的m7G帽会被帽结合蛋白CBP识别并介导,路经核孔转运至细胞质内来进行蛋白质翻译。但hTR和其他的非编码RNA [包括小核RNA(snRNA),小核小体RNA(snoRNA),和病毒RNA] 的m7G帽会被进一步甲基化为三甲基化鸟苷帽(m2,2,7G, TMG) 。这些RNA的细胞内转运调控与mRNA不同,其中TMG帽的修饰起了很大的作用。酵母细胞里端粒酶RNA的TMG帽需要yTGS1(三甲基化鸟苷合成酶)。有意思的是,在出芽酵母和分裂酵母里分别敲除yTGS1,会导致截然相反的端粒酶RNA的水平变化,以及相反的端粒长度变化。此外,人类细胞内hTR的TMG帽被哪个蛋白因子修饰还不清楚,而且三甲基帽对人类端粒酶和端粒长度的调控也有待进一步研究。
2020年2月5日,斯坦福大学癌症研究中心Steven E. Artandi的实验室和罗马大学Grazia D. Raffa实验室合作在 Cell Reports 杂志在线发表题为:Loss of Human TGS1 Hypermethylase Promotes Increased Telomerase RNAand Telomere Elongation 的研究论文。
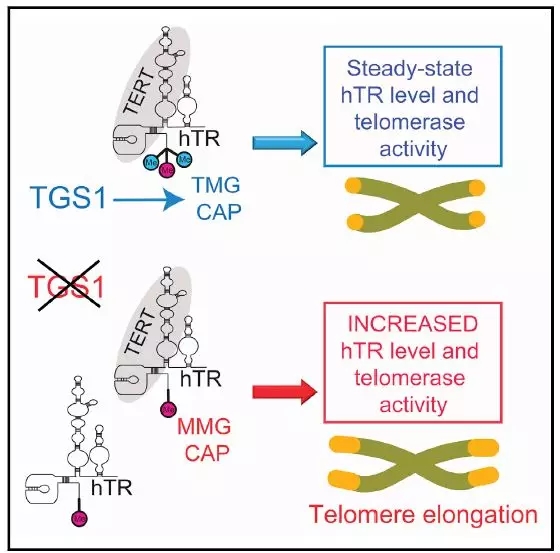
该研究第一次提供证据表明在人细胞里RNA三甲基化鸟苷合成酶(TGS1) 直接修饰了端粒酶RNA (hTR) 的三甲基化帽,TGS1的缺失会导致hTR的分子丰度和端粒酶活性的等比例增加,以至于人细胞内的端粒的伸长。
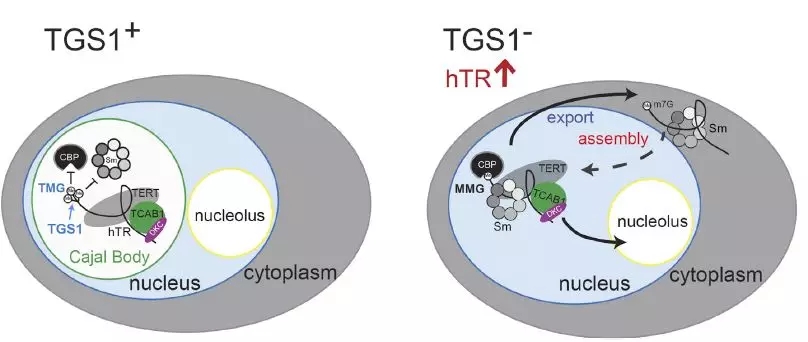
文章另外提出了端粒酶RNA (hTR) 稳定性增加和端粒伸长的分子细胞机理模型:在TGS1正常工作的人细胞里,TGS1和hTR都聚集在Cajal小体里,核小体外;hTR的5’鸟苷帽子被TGS1三甲基化后, 与帽结合蛋白CBP, RNA伴娘Sm复合体的亲和力保持较低状态。当TGS1被CRISPR失活后,hTR的5’帽子三甲基化不再,只留下单甲基化的hTR成为CBP和Sm的高亲和力结合伴侣, hTR也由CBP所介导,更多的被外送出细胞核。hTR细胞内外平衡的改变直接或间接的规避了hTR被RNA exosome识别降解的效率,因此导致了更多hTR的细胞内积累,更多的hTR和TERT在细胞核里的组装。由于Cajal小体在TGS1-KO细胞的瓦解,端粒酶大多会定位至核仁内。
作者在最后指出抑制TGS1和抑制PAPD5(hTR 的3'端多聚腺苷酸酶)在表型上有相似处:都是少有的能够提高hTR分子丰度和端粒酶活性,乃至端粒的伸长的分子途径。
因此,TGS1的抑制为治疗由端粒酶不足引发的疾病提供新的药物靶点,并为探索延缓人类衰老提出新的思路。
论文链接:
https://doi.org/10.1016/j.celrep.2020.01.004
本文来源:BioArt


