近日,德国杜伊斯堡-埃森大学的YuSi和Sven Brandau等对肿瘤中的中性粒细胞进行了三维定量多参数分析,证实了肿瘤核心区中LOX-1阳性中性粒细胞叛变成了肿瘤的帮凶,它们直接与T细胞作用,抑制其抗癌免疫功能。这一研究发表在Science Immunology[1]上。
癌细胞的忽悠名单,那可是长长的一串。帮着癌症超早转移的巨噬细胞、把循环肿瘤细胞粘在一起的血小板、为肿瘤供能解毒的成纤维细胞,统统都是信了癌细胞的鬼话。而免疫细胞中数量最多的中性粒细胞,自然也不会被癌细胞放过。
中性粒细胞是人体的快速反应部队,数量庞大,行动迅速。哪有了损伤感染,第一个扑上去的就是中性粒细胞。面对肿瘤时,中性粒细胞也可以通过炎症或者释放细胞因子,招募其它免疫细胞,来发挥一定的抗癌作用[2]。
不过更多的时候,中性粒细胞都被癌细胞忽悠瘸了。它帮着癌细胞降解基质、促进血管生成、刺激肿瘤细胞增殖、增加转移[3]。癌细胞还会把一些中性粒细胞变成多形核髓样抑制细胞(PMN-MDSC),专门抑制抗癌免疫反应,保证自己的生存[4]。

被中性粒细胞牺牲自己困住的细菌
(来自参考文献8)
中性粒细胞这种种叛变后的行为,让它们成为泛癌分析中,预后不良的最有力的预测指标之一[5]。但要想通过清除中性粒细胞来治疗肿瘤,问题就更多了。毕竟中性粒细胞还是人体抗击感染的主力之一,总不能把患者治成动不动就感冒,一感冒就肺炎的病秧子吧。
幸好,并不是所有的中性粒细胞都成了“坏蛋”。就算在肿瘤之中,被癌细胞包围的地方,也有着坚持敌后斗争的中性粒细胞小分队,它们肩负起了抗原呈递的责任,表面表达HLA-DR,可以把肿瘤抗原呈递给T细胞,刺激T细胞的活动[6]。
而另一类中性粒细胞,在肿瘤相关中性粒细胞(TAN)中占15%~50%的LOX-1阳性中性粒细胞,则似乎投敌叛变成了伪军,对免疫功能的抑制比一般的中性粒细胞更强[7]。
不过当时的研究中,并没有对组织中这些LOX-1阳性中性粒细胞的作用做出进一步的分析,类似的研究也有些不一致的结果,要想让它们认罪伏法还需要更多的证据。为此,Yu Si和Sven Brandau等使用2D和3D的定量多参数免疫荧光成像,对肿瘤中的中性粒细胞进行了研究。
研究人员发现,在肿瘤组织的不同区域中,T细胞基本均匀分布,而粒细胞的密度却有很大的差异,在肿瘤核心区中较少,在肿瘤周围基质组织中相对一致,但也随着靠近肿瘤核心而降低。
这些中性粒细胞中,很多都表达髓过氧化物酶(MPO)和精氨酸酶Ⅰ。这两种酶一个产生活性氧,一个产生活性氮,是中性粒细胞杀菌抗感染的重要手段,也是抑制T细胞活性的主要机制[7]。而敌后游击队般的HLA-DR阳性中性粒细胞数量有限,在大多数患者中不到20%。
至于我们的犯罪嫌疑人——LOX-1阳性中性粒细胞,在不同患者的肿瘤中的占比有很大的差异,但同样是在肿瘤核心区中的密度低于间质中的密度。而且,LOX-1和MPO常常一起表达,这也侧面证明了LOX-1阳性的中性粒细胞是替肿瘤抑制免疫功能的帮凶。

接下来,研究人员在喉癌和口咽癌中,进一步分析了TAN的位置和密度与临床结果之间的关系。在这两种癌症中,肿瘤核心区的LOX-1阳性TAN密度都跟预后不良密切相关,而间质组织中的TAN则和预后没什么关系。
数量较多的间质TAN和预后无关,只有核心区中少数的TAN才与预后不良相关,难怪之前的研究会得出不一致的结论了。
进一步对肿瘤组织中,中性粒细胞和T细胞的位置分析发现,这两类细胞的凭据距离要小于按它们随机分布计算出来的期望值,它们之间很可能存在着相互作用。算下来大约有5%~10%的中性粒细胞和T细胞彼此互相接近,配对。
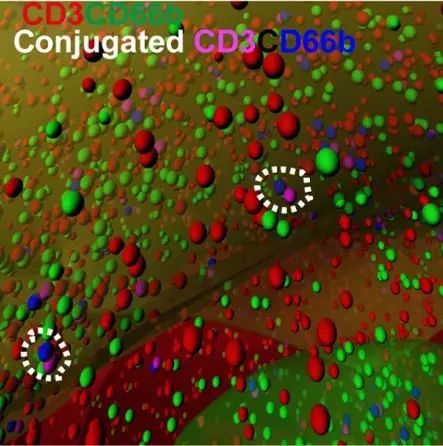
CD3:T细胞标志物;CD66b:中性粒细胞标志物;白圈中为配对的T细胞和中性粒细胞
而且那些与中性粒细胞配对的T细胞,细胞毒性分子GrzB的表达显著降低,而距离中性粒细胞100μm以上的T细胞则基本不受影响。
整体上看,肿瘤中表达MPO或者精氨酸酶Ⅰ的LOX-1阳性中性粒细胞的密度,与T细胞增殖速度和细胞毒性明显负相关,尤其是在肿瘤核心区。而HLA-DR阳性的中性粒细胞,则与T细胞增殖速度和细胞毒性正相关。
LOX-1阳性的中性粒细胞正是叛变投癌的汉奸!选择性的清除LOX-1阳性中性粒细胞,可能能打破肿瘤的免疫逃避,同时不影响身体正常的防御功能,或许可以成为一种新的肿瘤治疗方法。
参考文献:
1. Si Y, Merz S F, Jansen P, et al.Multidimensional imaging provides evidence for down-regulation of T celleffector function by MDSC in human cancer tissue[J]. Science Immunology, 2019,4(40): eaaw9159.
2. van Egmond M, Bakema J E. Neutrophils aseffector cells for antibody-based immunotherapy of cancer[C]//Seminars incancer biology. Academic Press, 2013, 23(3): 190-199.
3. Houghton A M G. The paradox oftumor-associated neutrophils: fueling tumor growth with cytotoxicsubstances[J]. Cell cycle, 2010, 9(9): 1732-1737.
4. Zhou J, Nefedova Y, Lei A, et al.Neutrophils and PMN-MDSC: Their biological role and interaction with stromalcells[C]//Seminars in immunology. Academic Press, 2018, 35: 19-28.
5. Gentles A J, Newman A M, Liu C L, et al.The prognostic landscape of genes and infiltrating immune cells across humancancers[J]. Nature medicine, 2015, 21(8): 938.
6. Singhal S, Bhojnagarwala P S, O'Brien S,et al. Origin and role of a subset of tumor-associated neutrophils withantigen-presenting cell features in early-stage human lung cancer[J]. CancerCell, 2016, 30(1): 120-135.
7. Condamine T, Dominguez G A, Youn J I, etal. Lectin-type oxidized LDL receptor-1 distinguishes population of humanpolymorphonuclear myeloid-derived suppressor cells in cancer patients[J].Science immunology, 2016, 1(2).
8. Brinkmann V, Reichard U, Goosmann C, etal. Neutrophil extracellular traps kill bacteria[J]. science, 2004, 303(5663):1532-1535.
头图来自pixabay.com
(来源于:奇点糕 奇点网)


