美国康奈尔大学威尔康奈尔医学院的研究人员们发现[1],肠道微生物竟然会调节大脑对恐惧记忆的消除!接受过抗生素治疗的小鼠,无法像普通小鼠一样很快意识到“威胁它们生命的事情已经结束了”这一点。
这是因为肠道微生物的变化通过一些分子,改变了大脑中的小胶质细胞的基因表达,导致神经元的连接方式也发生了改变。如果在生命早期恢复小鼠的肠道微生物的话,小鼠的这种认知能力也会恢复正常。研究发表在了《自然》杂志上。

图片来源:pixabay.com
听起来有点玄学,到底是怎么一回事呢?
首先,关于感知危险,主要指的是巴甫洛夫式习得恐惧,这是一种在进化上保守的联想学习过程。
巴甫洛夫的狗的故事,在经典的恐惧条件反射范式中,当刺激不再和提示一起出现时,就会发生“消退学习”,受到刺激的个体也会相应地学习改变自己的行为,不再因为提示的出现就做出与刺激有关的行为。
所以说,假如一个人(一只动物)消退学习有缺陷的话,在刺激,或者是危险已经过去之后,他(它)可能也很难去改变自己的行为。

图片来源:pixabay.com
一般来说,一些精神障碍,例如创伤后应激障碍(PTSD)和其他的一些焦虑障碍就和消退学习的缺陷有关[2]。患者在危险过去之后,仍然无法恢复到正常生活中,思维、记忆还会不由自主地反复出现见证过的或经历过的危险情境,在熟悉的环境下甚至会感觉到创伤性事件再次发生。
除此之外,还有过度警觉、注意力不集中、焦虑、易怒和回避相关情境或活动等表现。
几个月前,我们才介绍了肠道微生物与常见的精神障碍——抑郁症的关联,而且,更早的一些动物实验也发现,肠道微生物的缺少或改变会影响神经发生[3]、血脑屏障功能[4]和小胶质细胞的成熟[5],以及与压力相关的反应等等[6-8]。
但是研究们对于微生物如何影响行为的阐释有些是互相矛盾的,而且这其中的神经生物学机制也不是很清楚。

图片来源:pixabay.com
为了解释清楚这个问题,研究人员给小鼠进行了抗生素治疗,这些小鼠们的微生物载量是普通小鼠的1/600,微生物群结构也发生了改变。
研究人员接着开始帮助小鼠形成恐惧记忆,他们反复对小鼠进行电击,同时播放一些声音,让小鼠一听到声音就会联想到电击,表现出一些与恐惧有关的行为,比如说僵直。在恐惧记忆形成方面,普通小鼠和抗生素治疗小鼠是没有什么区别的。
接下来,他们进行了消退学习的实验:只播放声音,但不进行电击。重复几次后,普通小鼠很快意识到,这回虽然有声音,但没有电击了,它们的僵直行为逐渐消失,但抗生素治疗小鼠则不然,它们仍然在声音响起的时候出现僵直行为,一直没从恐惧记忆中“缓过来”。
同样的实验结果也发生在了无菌小鼠的身上。

在恐惧记忆的消退过程中,普通小鼠(蓝)和抗生素治疗小鼠(d红)、无菌小鼠(e红)发生僵直的比例变化
由此看来,恐惧记忆的形成或许与肠道微生物没什么关系,但是恐惧记忆的消退学习应该是由肠道微生物介导的。
以前的研究已经表明,恐惧记忆的消退很大程度上取决于大脑前额叶皮层[9]。研究人员对小鼠的大脑进行了扫描,发现普通小鼠比抗生素治疗小鼠有更少的树突棘的减少。
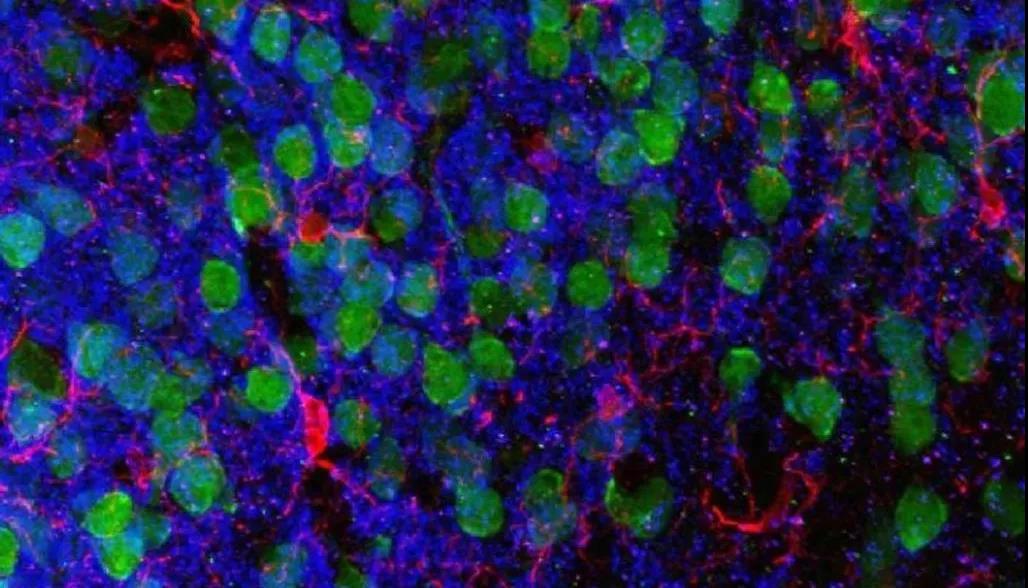
前额叶皮层内侧,皮质神经元(绿),小胶质细胞(红),图片来自于研究人员ChristopherParkhurst and David Artis
树突棘是树突分枝上的棘状突起,是神经元间形成突触的主要部位。产生突触和维持突触的能力是突触可塑性的重要组成部分,而突触可塑性对于记忆和学习是至关重要的。因此,抗生素治疗小鼠后,小鼠的突触可塑性受损,也难怪它们在消退学习上的表现要比普通小鼠差了。
另外,虽然有研究发现,肠道微生物的变化可以影响整个前额叶皮层的基因表达谱[10],但是研究人员还是想知道,究竟是哪些具体的脑细胞直接影响了小鼠的消退学习能力。
利用单细胞测序,他们发现,小胶质细胞中的基因表达变化最为可疑。抗生素治疗小鼠的小胶质细胞似乎在“发育方面”有些问题,它们的一些与细胞未成熟状态相关的基因表达水平很高,与普通小鼠差异很大。
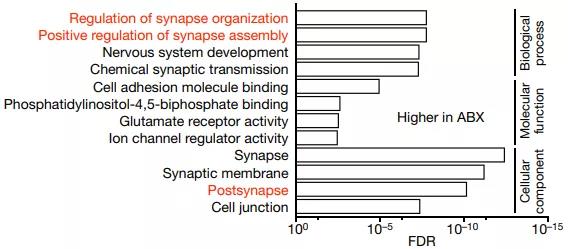
抗生素治疗小鼠小胶质细胞中的一些和普通小鼠表达有差异的基因相关的功能
小胶质细胞作为大脑中的免疫细胞,有吞噬和降解不需要突触的功能,大脑可以根据自己的需求来对神经元的连接进行修剪和维持。不成熟的小胶质细胞或许在这个过程中,没有好好执行自己的任务,一定程度上影响了小鼠的消退学习的能力。
说到这里,大家可能会觉得,这个影响链条中间好像还差了一环,是的,肠道微生物是如何跨越万水千山影响了大脑的呢?这一点研究人员也给出了解释。
对于大脑,虽然肠道微生物“身不能至”,但是有代谢产物可以为它们跑腿啊。通过对小鼠的脑脊液进行分析,研究人员发现,有四种代谢产物的水平发生了变化,明显低于普通小鼠,而这些代谢产物的水平变化也曾在人类精神分裂症和自闭症等精神疾病中出现过。
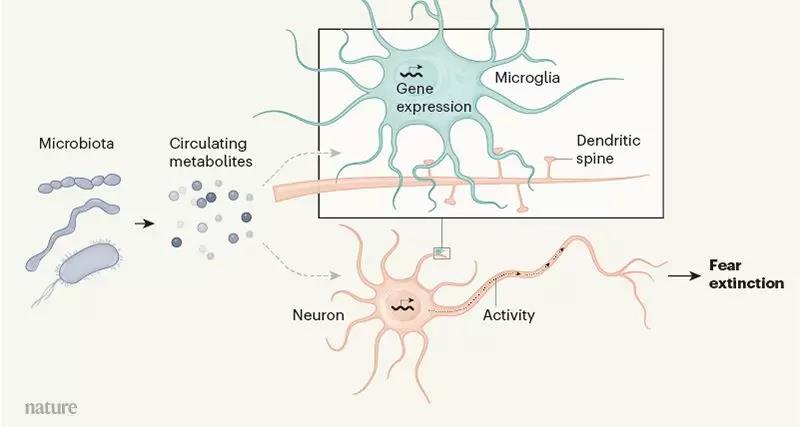
肠道微生物通过代谢产物调节小鼠恐惧消退的过程[11]
最后,研究人员尝试了给无菌小鼠移植肠道微生物,看看是否能够恢复它们的消退学习能力,结果发现,确实可以,不过,这得建立在小鼠刚出生后就迅速进行移植的前提下。研究人员表示,这说明,肠道微生物在生命早期的学习能力的建立上就很重要。
虽然这不是第一个研究恐惧记忆和肠道微生物关系的研究,但是却是第一个发现恐惧记忆消退的特殊缺陷的研究[11]。这项研究的潜在应用是很广泛的,因为包括创伤后应激障碍在内,几乎所有的神经精神疾病患者都有突触可塑性的缺陷,研究会为它们提供新的思路。
参考资料:
[1] Chu C, Murdock M H, Jing D, et al. Themicrobiota regulate neuronal function and fear extinction learning[J]. Nature,2019, 574(7779): 543-548.
[2] VanElzakker M B, Dahlgren M K, Davis FC, et al. From Pavlov to PTSD: the extinction of conditioned fear in rodents,humans, and anxiety disorders[J]. Neurobiology of learning and memory, 2014,113: 3-18.
[3] Möhle L, Mattei D, Heimesaat M M, etal. Ly6Chi monocytes provide a link between antibiotic-induced changes in gutmicrobiota and adult hippocampal neurogenesis[J]. Cell reports, 2016, 15(9):1945-1956.
[4] Braniste V, Al-Asmakh M, Kowal C, etal. The gut microbiota influences blood-brain barrier permeability in mice[J].Science translational medicine, 2014, 6(263): 263ra158-263ra158.
[5] Erny D, de Angelis A L H, Jaitin D, etal. Host microbiota constantly control maturation and function of microglia inthe CNS[J]. Nature neuroscience, 2015, 18(7): 965.
[6] Vuong H E, Yano J M, Fung T C, et al. Themicrobiome and host behavior[J]. Annual review of neuroscience, 2017, 40:21-49.
[7] Hoban A E, Stilling R M, Moloney G, etal. The microbiome regulates amygdala-dependent fear recall[J]. Molecularpsychiatry, 2018, 23(5): 1134.
[8] Lu J, Synowiec S, Lu L, et al.Microbiota influence the development of the brain and behaviors in C57BL/6Jmice[J]. PloS one, 2018, 13(8): e0201829.
[9] Maren S, Phan K L, Liberzon I. Thecontextual brain: implications for fear conditioning, extinction andpsychopathology[J]. Nature reviews neuroscience, 2013, 14(6): 417.
[10] Hoban A E, Stilling R M, Ryan F J, etal. Regulation of prefrontal cortex myelination by the microbiota[J].Translational psychiatry, 2016, 6(4): e774.
[11] https://www.nature.com/articles/d41586-019-03114-1
(来源于:奇点糕 奇点网)


