近日,癌症免疫治疗领域又取得突破性进展。
来自以色列魏茨曼科学研究院的Yardena Samuels与美国国家癌症研究所的Eytan Ruppin联合团队发现,在黑色素瘤中,肿瘤内异质性(ITH)越高,免疫系统抗癌的能力就越容易被抑制,癌症进展的就更快。
而且,他们还发现,在黑色素瘤中,相比于肿瘤突变负荷(TMB)等因素,肿瘤内异质性对免疫治疗的效果影响更大。甚至肿瘤内异质性对免疫治疗疗效的预测,比TMB更好。这项重要的研究成果发表在顶级期刊《细胞》上[1]。
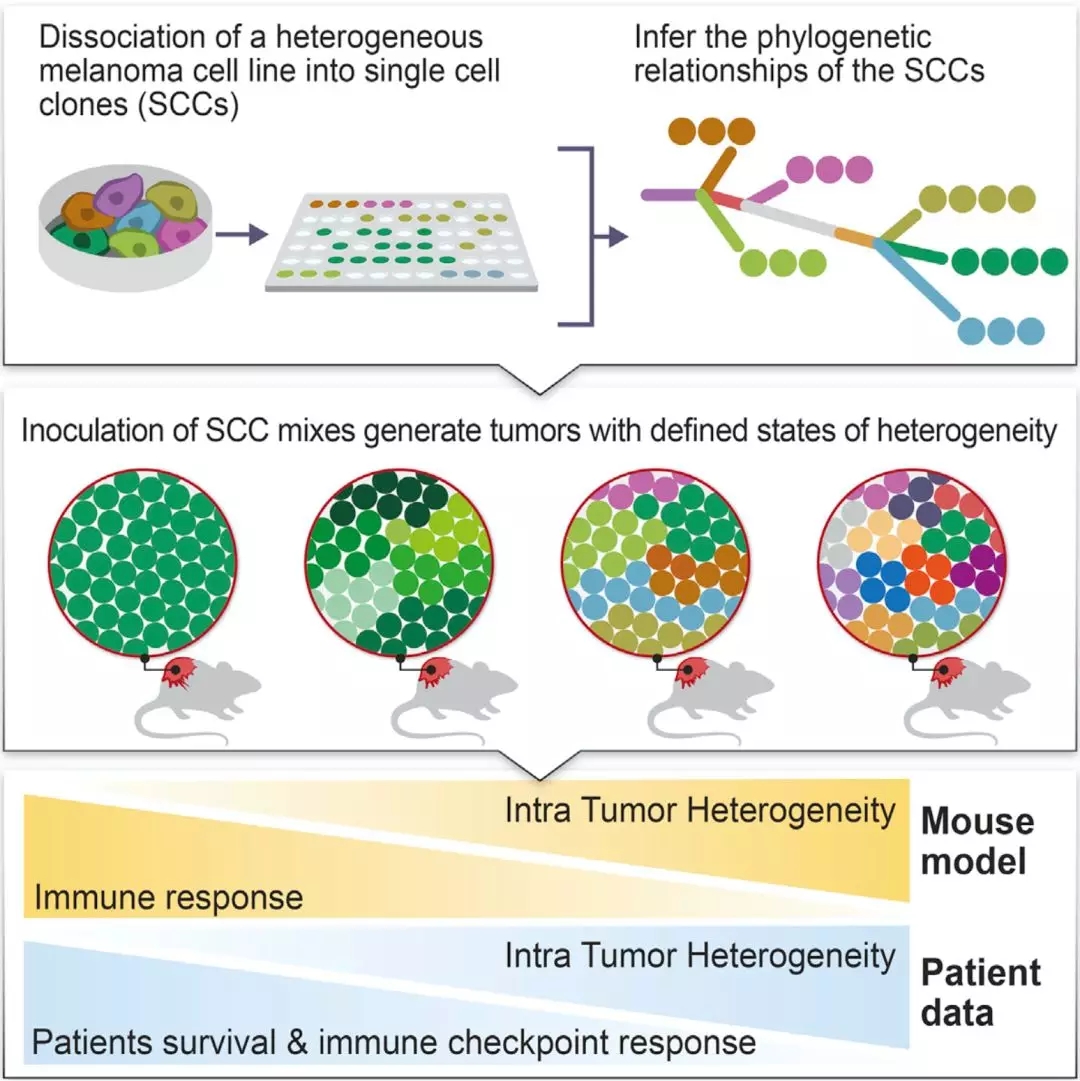
▲ 肿瘤异质性与免疫响应和患者生存之间的关系
说起肿瘤免疫治疗,我们都知道,在肿瘤免疫治疗领域有个非常重要的假设:肿瘤的突变负担,也就是TMB越大,新抗原就越多,肿瘤的免疫原性就越强[2,3]。
言外之意,TMB越高,免疫治疗效果应当更好。
近年来的一些研究也确实证实,TMB高与免疫检查点抑制剂治疗效果好相关[2-6]。去年,全球首个Ⅲ期前瞻性临床研究表明,TMB可以作为免疫治疗疗效的预测方法[7]。
不过,与此同时,很多科学家也观察到,TMB高的患者对免疫治疗的反应也不一致[8],很多TMB低的患者对免疫治疗也有反应[9]。
这就让很多科学家对TMB与免疫治疗之间的关系起了疑心,“恐怕不靠谱啊,背后肯定还有其他的重要因素没有被逮到。”
▲ 免疫细胞(该图片由David Mark在Pixabay上发布)
那么这个躲藏在幕后操纵一切的无形之手究竟是啥呢?
思路得从科研论文里面找。
Samuels和Ruppin团队的研究人员注意到,最近有些研究发现肿瘤内的异质性(ITH)可能会影响免疫系统对它监视[10-12]。
肿瘤内的异质性是啥意思呢?实际上,肿瘤细胞在分裂增殖的过程中,它们的后代在基因上会与前面的肿瘤细胞出现差异,这就是肿瘤的进化,是肿瘤细胞的之间的遗传多样性。
有些读者可能要问了,那这和TMB有啥区别?虽然TMB和肿瘤的异质性“你中有我,我中有你”,但是还真有区别。例如,TMB很高的肿瘤异质性可能很低;而一个异质性很高的肿瘤也可以有很低TMB。这是为啥呢?
举个极端的例子,如果一个肿瘤里面的所有细胞都是同一个细胞的翻版,那无论这个肿瘤细胞里面有多少突变,它们都是一毛一样的。这个肿瘤可以说就没有异质性了,哪怕它的TMB大破天。反之亦然。当然这种现象在临床上是不存在的。
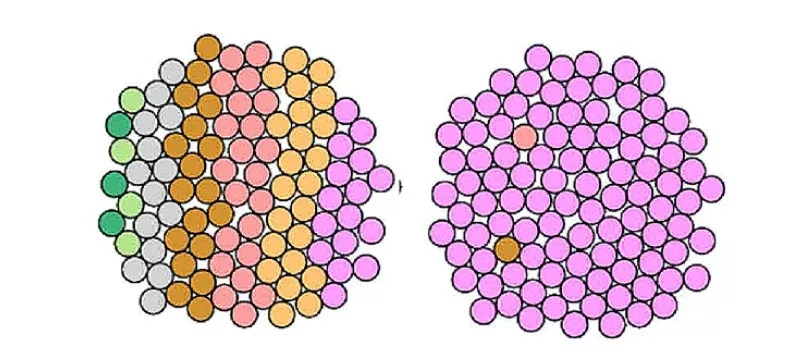
▲ 左图异质性高,右图异质性低
实际上,已经有一些研究观察到了肿瘤内异质性低与患者预后好之间存在相关性[13,14]。这就意味着肿瘤的异质性与肿瘤的免疫监视高度相关,确实值得研究。
研究人员首先在现有的TCGA数据库中做了初步分析。他们发现,对于黑色素瘤患者而言,患者的TMB和基因的拷贝数变异,作为单一预测因子,与患者的生存率没有相关性。但是肿瘤异质性低的患者,生存期明显好于异质性高的。这也与之前的研究结果一致。
进一步分析发现,异质性高且TMB或拷贝数变异低的患者,生存率最差。控制潜在的混杂因素之后,这个结果仍然成立。
这些结果清晰地告诉研究人员,肿瘤的异质性对患者的生存影响非常大。真的值得单独研究。
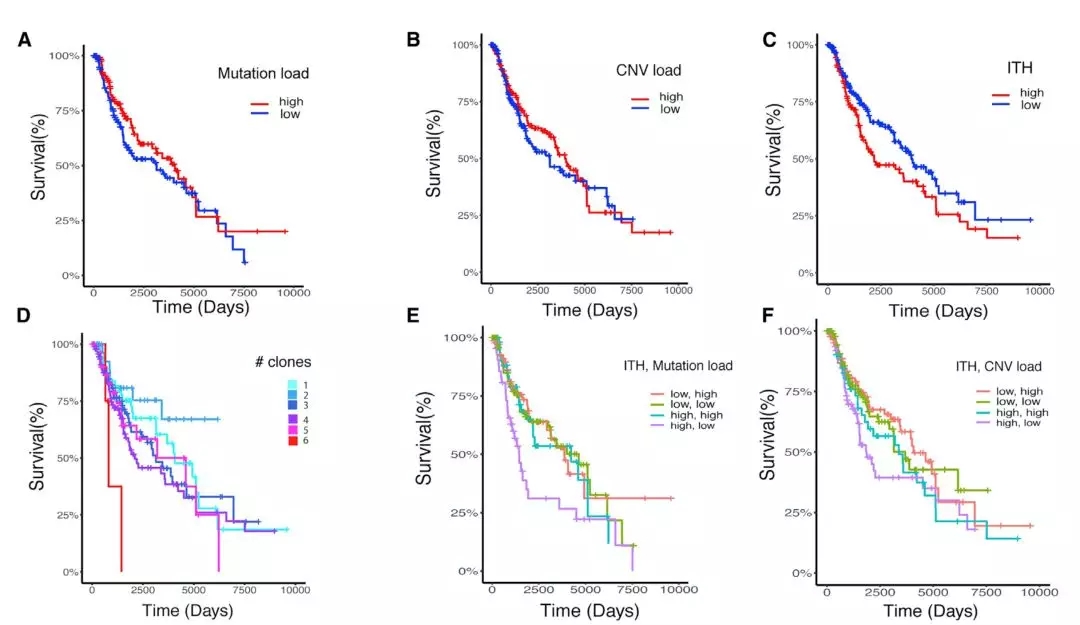
▲ 各种不同的因素与患者生存率之间的关系
不过,摆在研究人员面前的一个问题是,尽管TMB与异质性存在不同,但是正如我们前面说过的那样,它们二者大部分时候是“你中有我,我中有你”,要单独拆开来研究是非常不容易的。
本研究的创新之处在此时就迸发出来了。
研究人员用适度的紫外线(UVB)照射一个黑色素瘤细胞系,照完之后做全外显子测序。结果和预料的一样,照射后的黑色素瘤细胞的TMB升高了,异质性也升高了。不过,经过紫外线照射的细胞在培养皿里的生长速度却变慢了。
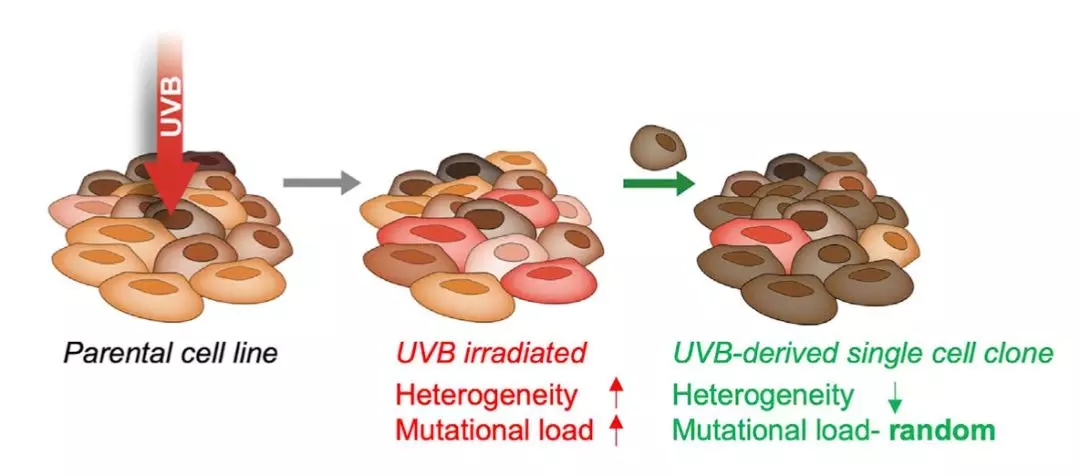
▲ 细胞系被UVB处理过程
然后他们将未经紫外线照射,和紫外线照射处理的癌细胞,分别移植到不同的小鼠体内。结果发现经过紫外线照射的癌细胞,在小鼠体内形成的肿瘤,生长速度却是明显变快了。这暗示,紫外线照射后的癌细胞,对免疫系统的抑制似乎变得更强了。
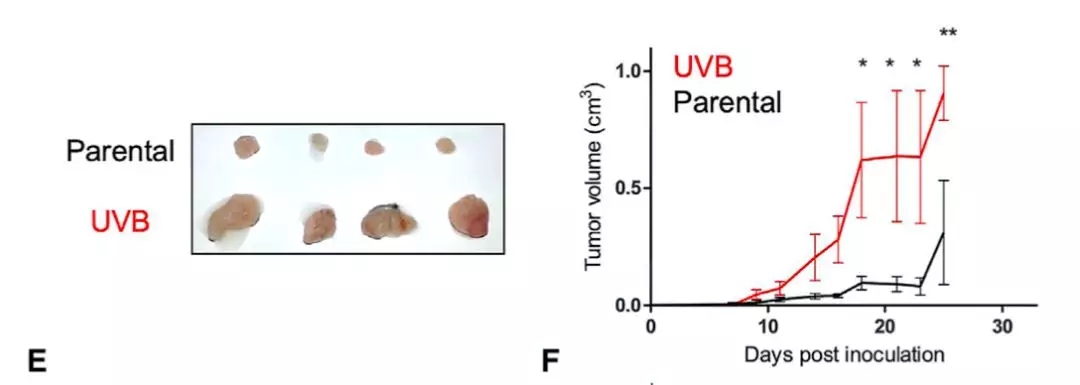
▲ UVB照射后,癌细胞变得狂野了
随后,研究人员用PD-1抑制剂分别处理两组小鼠,结果正如研究人员预期的那样:经过紫外线照射的癌细胞,对PD-1抑制剂的反应小。这进一步暗示,肿瘤的异质性在背后捣鬼。
眼尖的朋友肯定已经注意到了,上面的实验设计并没有将TMB撇开。
为了解决这个问题,研究人员做了一个巧妙的设计。
他们从经过紫外线处理的黑色素瘤细胞中,单独分离出来了两个单细胞克隆(SCC)。单细胞测序结果发现,这两个单细胞克隆的异质性非常低,细胞的突变量差异也非常大,从3600到16977个体细胞突变的细胞都有。
然后把这两个单细胞克隆和它们的亲代细胞分别移植到不同的小鼠身上,结果出人意料。异质性极低的单细胞克隆丢失了亲代的攻击性表型,变得特别不爱生长。
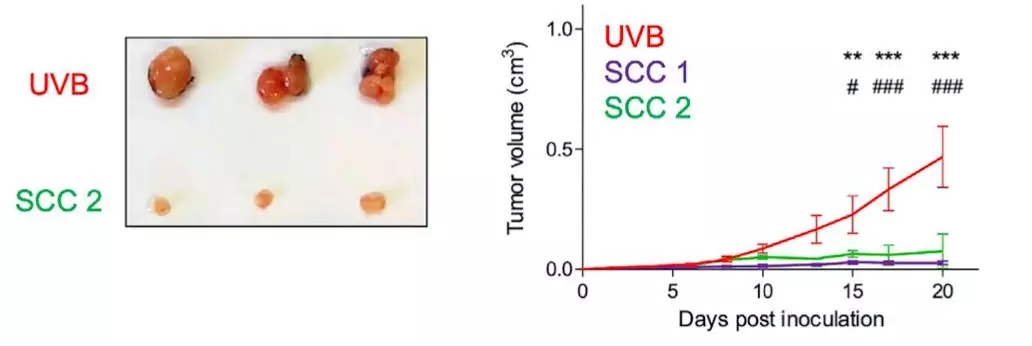
▲ 和爹妈相比,单克隆(SCC)似乎都不太行
为了进一步确认,研究人员又分离了20个单细胞克隆,和上面的结果一致,长出的肿瘤非常小,一般在2-3周左右就自行消失了。这基本就确定异质性低与肿瘤攻击性低有关。
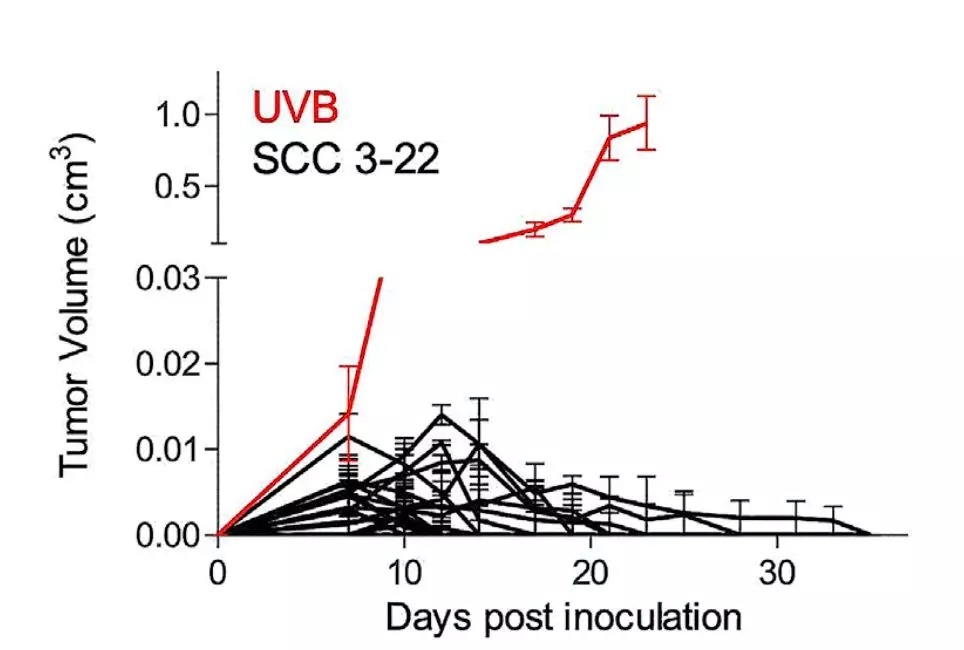
▲ 所有的单克隆都不行
在后面的研究中,研究人员还将上面的20个克隆分组混合移植给小鼠,发现混合的越多,异质性越高,肿瘤的生长速度越快。即使是在突变负荷相似的条件下,这个结论仍然成立。这就证实:肿瘤内异质性决定了肿瘤的增长。
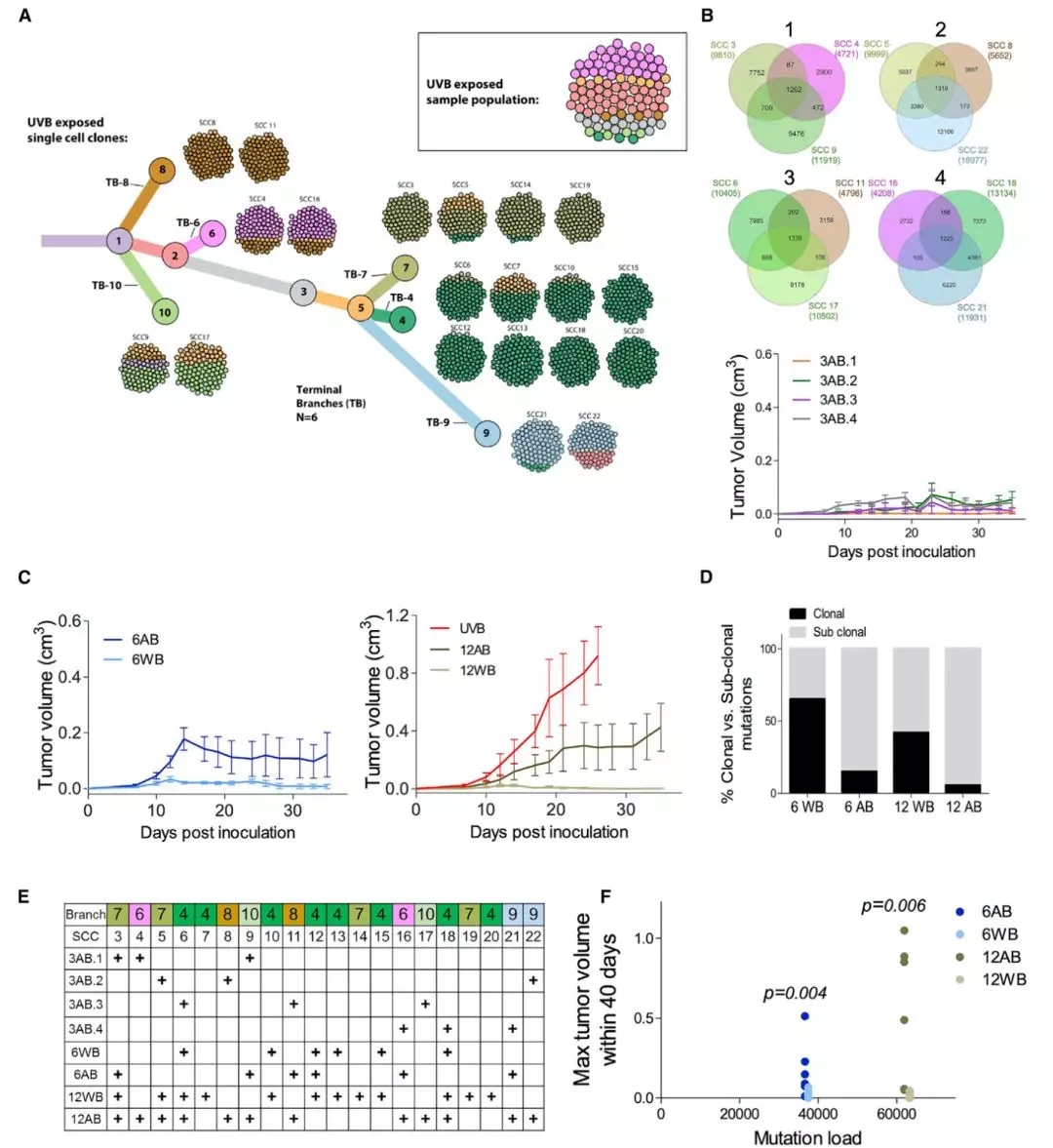
▲ 混合研究实验
那背后的原因又是什么呢?
研究人员发现,异质性低更容易被免疫系统排斥。如果敲除小鼠体内的T细胞,它们就可以和“爸爸妈妈们”一样放肆生长了。

▲ 没有了免疫系统的压制,单克隆活了
说来也奇怪,对于那些单克隆癌细胞形成的肿瘤而言,T细胞浸润更多,而且T细胞也更活跃,甚至连有免疫抑制功能的调节T细胞都变少了。
研究人员认为,相比于异质性低的肿瘤而言,异质性高的肿瘤由于新抗原被“被稀释”,就变得没有免疫原性。
最后,研究者们分析了经过PD-1抑制剂或CTLA-4抑制剂体治疗的患者生存率,发现患者生存率与肿瘤的异质性密切显著相关,而TMB没有显著相关性。
总的来说,这个研究表明,肿瘤的异质性是个很好的预测黑色素瘤疗效的标志物,而且可以与TMB联合使用。
参考资料:
[1].Wolf, Y., Bartok, O., Patkar, S., Eli,G. B., Cohen, S., Litchfield, K., ... & Karathia, H. (2019). UVB-InducedTumor Heterogeneity Diminishes Immune Response in Melanoma. Cell.
[2].Germano, G., Lamba, S., Rospo, G.,Barault, L., Magrì, A., Maione, F., ... & Siravegna, G. (2017).Inactivation of DNA repair triggers neoantigen generation and impairs tumourgrowth. Nature, 552(7683), 116.
[3].Hellmann, M. D., Nathanson, T., Rizvi,H., Creelan, B. C., Sanchez-Vega, F., Ahuja, A., ... & Liu, C. (2018).Genomic features of response to combination immunotherapy in patients withadvanced non-small-cell lung cancer. Cancer Cell, 33(5), 843-852.
[4].Chan, T. A., Yarchoan, M., Jaffee, E.,Swanton, C., Quezada, S. A., Stenzinger, A., & Peters, S. (2018).Development of tumor mutation burden as an immunotherapy biomarker: utility forthe oncology clinic. Annals of Oncology, 30(1), 44-56.
[5].Samstein, R. M., Lee, C. H.,Shoushtari, A. N., Hellmann, M. D., Shen, R., Janjigian, Y. Y., ... &Kaley, T. J. (2019). Tumor mutational load predicts survival afterimmunotherapy across multiple cancer types. Nature genetics, 51(2), 202-206.
[6].Snyder, A., Makarov, V., Merghoub, T.,Yuan, J., Zaretsky, J. M., Desrichard, A., ... & Hollmann, T. J. (2014).Genetic basis for clinical response to CTLA-4 blockade in melanoma. New EnglandJournal of Medicine, 371(23), 2189-2199.
[7].Hellmann, M. D., Ciuleanu, T. E.,Pluzanski, A., Lee, J. S., Otterson, G. A., Audigier-Valette, C., ... &Borghaei, H. (2018). Nivolumab plus ipilimumab in lung cancer with a high tumormutational burden. New England Journal of Medicine, 378(22), 2093-2104.
[8].Rooney, M. S., Shukla, S. A., Wu, C.J., Getz, G., & Hacohen, N. (2015). Molecular and genetic properties oftumors associated with local immune cytolytic activity. Cell, 160(1-2), 48-61.
[9].Miao, D., Margolis, C. A., Gao, W.,Voss, M. H., Li, W., Martini, D. J., ... & Horak, C. (2018). Genomiccorrelates of response to immune checkpoint therapies in clear cell renal cellcarcinoma. Science, 359(6377), 801-806.
[10].McDonald, K. A., Kawaguchi, T., Qi,Q., Peng, X., Asaoka, M., Young, J., ... & Takabe, K. (2019). TumorHeterogeneity Correlates with Less Immune Response and Worse Survival in BreastCancer Patients. Annals of surgical oncology, 26(7), 2191-2199.
[11].McGranahan, N., Furness, A. J.,Rosenthal, R., Ramskov, S., Lyngaa, R., Saini, S. K., ... & Watkins, T. B.(2016). Clonal neoantigens elicit T cell immunoreactivity and sensitivity toimmune checkpoint blockade. Science, 351(6280), 1463-1469.
[12].Rosenthal, R., Cadieux, E. L.,Salgado, R., Al Bakir, M., Moore, D. A., Hiley, C. T., ... & Henry, J. Y.(2019). Neoantigen-directed immune escape in lung cancer evolution. Nature,567(7749), 479.
[13].Andor, N., Graham, T. A., Jansen, M.,Xia, L. C., Aktipis, C. A., Petritsch, C., ... & Maley, C. C. (2016).Pan-cancer analysis of the extent and consequences of intratumor heterogeneity.Nature medicine, 22(1), 105.
[14].Miao, D., Margolis, C. A., Vokes, N.I., Liu, D., Taylor-Weiner, A., Wankowicz, S. M., ... & Manos, M. (2018).Genomic correlates of response to immune checkpoint blockade inmicrosatellite-stable solid tumors. Nature genetics, 50(9), 1271.
(来源于: 奇点糕 奇点网)


